Química orgánica
La química orgánica es la química de los compuestos de carbono
INTRODUCCIÓN
La quimica orgánica trata de los compuestos del carbono, ya sea producidos por los seres vivos u obtenidos por síntesis . Y el objeto de la misma no es otro que el estudio de los citados compuestos , que existen en gran número. Al ser éstos muy diferentes , en sus propiedades de las combinaciones que tienen los demás elementos , puede fácilmente comprenderse las importancia de esta gran división de la química descriptiva.
Durante mucho tiempo, las sustancias orgánicas se produjeró exclusivamente a expensas de los seres vivos animales o vegetales y se llegó a pensar que la intervenciòn de la vida era indispensable para llegar a eleborar está materia. Posteriormente, la realización de síntesis orgánicas , a partir de sustancias minerales, desmintió por completó esta teoría . en la actualidad , la inmensa mayoría de los compuestos orgánicos se pueden obtener por vía sintética , aunque la industria prefiere, en ciertos casos,recurrir a procedimientos de extracción para sustancias como el azúcar, caucho, celulosa , almid´on , etc. Sin embargo, algunsa síntesis, como las del metanol y el ácido ácetico , pueden competir desde el punto de vista économico con los procesos de extracción correspondiente.
Se conocen moléculas orgánicas que contienen miles de átomos, cuyo ordenamiento puede ser muy complicado, aun en moléculas relativamente pequeñas. Uno de los principales problemas en química orgánica es encontrar cómo se ordenan los átomos en las moléculas, o sea, determinar las estructuras de los compuestos.
Hay muchas maneras en que estas complicadas moléculas pueden romperse o reordenarse para generar moléculas nuevas; hay muchas formas de agregar átomos a estas moléculas o de sustituir átomos nuevos por antiguos. Una parte importante de la química orgánica se dedica a encontrar estas reacciones, cómo suceden y cómo pueden emplearse para sintetizar las sustancias que se requieren
EL ÁTOMO DE CARBONO Y EL ENLACE QUIMICO
el estudio de la química orgánica moderna exige un conocimiento claro de las caracteristicas fundamentales del átomo de carbono y del enlace covalente
El átomo de carbono
la base fundamentla de la química orgánica estructural es el átomo de carbono. Sus caracteristicas sobresalinetes son : (1) el hecho de ser tetravalente es decir, que se puede ligar con cuatró átomos o grupos, iguales o diferentes; (2) su capacidad para formar enlaces estables consigo mismo; (3) su estructura tetraédrica
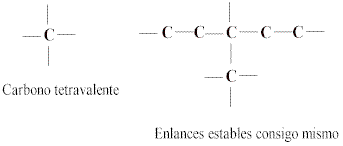
Estas propiedades hacen del carbono un elemento único y extraordinario, capàz de formar cadenas extremadamente largas y complejas, lo mismo que anillos carbonados de muy diversas formas y tamaños. Se conocen ya unos dos millones de compuestos de carbono, de los cuales un gran número ha sido preparado en el laboratorio, y se cree que las posibilidades de síntesis son infinitas
El hecho de que las cuatro valencias del carbono están dirigidas hacia los vértices de un tetraedro regulas regular , cuyo ángulo es 109º28´, es la causa de que las cadenas carbonadas no sean lineales sino en forma de zigzag y con ángulos cercanos al valor teórico
ORBITALES ATÓMICOS
La región en el espacio en la que es probable que se encuentre un electrón se denomina orbital . Este se evidencia como una expresión matemática que describe el comportamiento de un electrón al moverse en la cercanìa de un nùcleo cargado positivamente. Hay diferentes tipos de orbitales, con tamaño y formas diferentes, y que están dispuestos en torno al núcleo de maneras específicas. El tipo particular de orbital que ocupa un electrón depende de su energía. es importante conocer especialmente las formas de estos orbitales y sus posiciones recíprocas, puesto que determinan las disposición espacial de los átomos de una molécula e incluso ayudan a determinar su comportamiento químico.
Es útil visualizar un electrón como si se difundiera para formar una nube. La forma de la nube es la forma del orbital. La nube no es uniforme, sino que es más densa en aquellas regiones en las cuales la probabilidad de hallar el electrón es máxima, o sea, en aquellas regiones donde la carga negativa promedio, o densidad electrónica , es máxima.
Forma de los orbitales átomicos;
Descripción |
Forma |
El orbital correspondiente al nivel energético más bajo se denomina 1s, y es una esfera cuyo centro coincide con el núcleo del átomo, |
|
En el nivel energético siguiente se encuentra el orbital 2s, que también es una esfera con su centro en el núcleo atómico, y es naturalmente mayor que el 1s: la mayor energía (menor estabilidad) se debe a la mayor distancia promedio entre el electrón y el núcleo, con la consiguiente disminución de la atracción electrostática. |
|
A continuación hay tres orbitales de igual energía, llamados orbitales 2p, ilustrados en la figura. Cada orbital 2p tiene forma de huso y consta de dos lóbulos entre los cuales está el núcleo atómico. El eje de cada orbital 2p es perpendicular a los ejes de los otros dos. Se diferencian por los símbolos 2p x , 2p y y 2p z , en los que x, y y z son los ejes correspondientes. Orbitales átomicos (a) Sección transversal mostrando los dos lóbulos de un orbital individual. (b) Forma aproximada de pares de elipsoides distorsionados. (c) Representación como pares de esferas que no llegan a tocarse .
|
Un orbital no tiene un límite definido, puesto que hay una probabilidad, aunque muy pequeña, de encontrar el electrón esencialmente separado del átomo, e incluso sobre otro átomo. Sin embargo, la probabilidad decrece muy rápidamente más allá de cierta distancia del núcleo.
EL ENLACE COVALENTE
Para que se forme un enlace covalente, deben ubicarse dos átomos de manera tal que el orbital de uno de ellos solape al orbital del otro; cada orbital debe contener solamente un electrón. Cuando sucede esto, ambos orbitales atómicos se combinan para formar un solo orbital de enlace ocupado por ambos electrones, que deben tener espines opuestos, Cada electrón dispone del orbital de enlace entero, por lo que puede considerarse como < < perteneciente > > a ambos núcleos atómicos.
ORBITALES MOLECULARES
Para que se pueda formar un enlace covalente entre dos átomos es necesario que estos se acerquen en tal forma que el orbital átomico del uno se puperponga al del otro y se produzca una interpenetración . Al combinarse los dos orbitales átomicos , se forma uno nuevo , el orbital molecular que rodea simetricamente a los dos núcleos . Lo mismo que en el caso de los orbitales atómicos , el orbital molecular sólo puede estar ocupado por un maximo de dos electrones
El orbital sigma
Este orbital de enlace tiene aproximadamente la forma que se espera obtener de la fusión de dos orbitales s. Tal como indica la figura tiene aspecto de salchicha, cuyo eje mayor coincide con la línea que une los núcleos; en torno a este eje, es cilíndricamente simétrico, o sea, un corte de esta salchicha es circular. Los orbitales de enlace que tienen este aspecto, se denominan orbitales o (orbitales sigma) y los enlaces correspondientes son los enlaces o. Se puede visualizar la molécula de hidrógeno como formada por dos núcleos sumergidos en una sola nube electrónica con forma de salchicha. La densidad máxima de la nube está en la región entre ambos núcleos, donde la carga negativa es atraída más intensamente por las dos
A manera de ejemplo, considerese la formación de la molécula de hidrógeno, H 2 , a partir de dos átomos. Cada átomo de hidrógeno tiene un electrón, el cual ocupa el orbital 1s. Para que se forme un enlace, ambos núcleos deben acercarse lo suficiente para que se produzca el solapamiento de los orbitales atómicos (como lo expone la figura ). Para el hidrógeno, el sistema más estable resulta cuando la distancia entre los núcleos es de 0.74 A, denominada longitud de enlace.
Formaciòn del orbital sigma en la molécula de hidrógeno : (a) Orbitales s separados , (b) solapamiento de orbitales s, (c) y (d) el orbital de enlace sigma
Como indica el ejemplo, un enlace covalente resulta del solapamiento de dos orbitales atómicos para formar un orbital de enlace ocupado por un par de electrones. Cada tipo de enlace covalente se caracteriza por una longitud y una fuerza características.
El orbital pi
Cuando los átomos interaccionantes disponen de orbitales átomicos 2p con electròn solitario , se forma un orbital molécular diferente que no es rotacionalmenbte simétrico alrededor del eje que conecta los dos núcleos . y se llama orbital molécular pi . La unión resultante es un enlace pi;
El concepto de << solapamiento >> es el que proporciona el puente mental entre orbitales atómicos y de enlace. El solapamiento de orbitales atómicos significa que el orbital de enlace ocupa gran parte de la región espacial previamente cubierta por ambos orbitales atómicos. En consecuencia, un electrón de un átomo puede permanecer en gran medida en su ubicación original, favorable con respecto a su núcleo, y ocupar, al mismo tiempo, una posición favorable similar con respecto al segundo núcleo; por supuesto, esto mismo vale para el otro electrón.
HIBRIDACIÓN DE ORBITALES ÁTOMICOS
El concepto de translape de los orbitales atómicos se puede aplicar también a moléculas poliatómicas. Sin embargo, un esquema satisfactorio del enlace tambièn debe explicar la geometría molecular . A continuación se mostraran los aspectos generales que resumen la hibridación:
-
El concepto de hibridación no se aplica a átomos aislados. Es un modelo teórico que sólo se utiliza para explicar el enlace covalente
-
La hibridación es la mezcla de, por lo menos , dos orbitales atómicos no equivalentes, por ejemplo orbitales s y p. Como consecuencia, un orbital híbrido no es un orbital atómico puro . Los orbitales híbridos y los orbitales átomicos puros tienen formas muy diferentes.
-
El número de orbitales híbridos generados es igual al número de orbitales atómicos puros que participan en el proceso de hibridación.
-
La hibridación requiere de energía; sin embargo , el sistema recupera de sobra esta energía durante la formación del enlace
-
Los enlaces covalentes en las moléculas y en los iones poliatómicos se forman por el translape de orbitales hibridos, o de orbitales con orbitales puros . Como consecuencia , el esquema de hibridación en el enlace está en el contexto de la teoría del enlace de valencia ; se supone que los electrones en una molécula ocupan orbitales híbridos de los átomos individuales
La siguiente tabla resume las hibridaciones sp, sp2 y sp3
ORBITALES ATÓMICOS PUROS DEL ÁTOMO CENTRAL |
HIBRIDACIÓN DEL ÁTOMO CENTRAL |
NÚMERO DE ORBITALES HÍBRIDOS |
FORMA DE LOS ORBITALES HÍBIRDOS |
EJEMPLOS |
s, p
|
sp |
2 |
Metano CH4 |
|
s, p, p
|
sp2 |
3 |
Eteno C2H4
|
|
s, p, p, p |
sp3 |
4 |
Etino C2H2
|
ISOMERIA
Los compuestos diferentes que tienen la misma fórmula molecular se llaman isómeros ( del griego: isos, igual, y meros, parte). Contienen igual número de las mismas clases de átomos, pero éstos están unidos entre sí de manera distinta. Los isómeros son compuestos diferentes, porque tienen estructuras moleculares distintas.
La isomería puede ser de dos tipos:
- Isomería constitucional
- Isomería en el espacio o esteroisomería
1. Isomería constitucional
Las moléculas que presentan este tipo de isomería se diferencian en la conectividad , es decir,tienen los mismos átomos conectados de forma diferente (distinta fórmula estructural).
La isomería constitucional se clasifica en:
- Isomería de cadena u ordenación .Presentan isomería de cadena u ordenación aquellos compuestos que tienen distribuidos los átomos de C de la molécula de forma diferente .
- Isomería de posición .La presentan aquellos compuestos que teniendo las mismas funciones químicas están enlazadas a átomos de carbono que tienen localizadores diferentes.
-
Isomería de función .La presentan aquellos compuestos que tienen distinta función química .
- Metámeros .Tienen el mismo grupo funcional sustituido de formas distintas .
2. Isomería en el espacio o esteroisomería
La isomería en el espacio se clasifica en:
- Isomería configuracional
- Isomería conformacional
La isomería configuracional se clasifica a su vez en:
-
Estereoisomería geométrica .La presentan los compuestos que se diferencian únicamente en la disposición de sus átomos en el espacio.Moléculas con fórmulas moleculares idénticas pueden presentar estructuras espaciales diferentes .Estas moléculas pueden ser:
-
Aquellas cuyas cadenas tienen dobles enlaces. Una característica del doble enlace es su rigidez ,que impide la libre rotación y reduce los posibles intercambios de posición que pueden experimentar los átomos de una molécula.
-
Sistemas cíclicos planos
-
Sistemas cíclicos plegados
-
-
Estereoisomería óptica .Las moléculas que presentan este tipo de isomería de diferencian únicamente en el efecto que tienen sobre la luz .Recibe el nombre de molécula quiral aquella que no se puede superponer con su imagen especular .Toda molécula no quiral recibe el nombre de aquiral .Si una molécula posee un plano de simetría es aquiral .Una molécula quiral puede presentar, al menos, dos configuraciones diferentes ,una imagen especular de la otra ,que constituyen una pareja de enantiómeros .Uno de ellos gira el plano de polarización de la luz hacia la derecha (dextrógiro) y se identifica con la letra R ;el otro gira el plano de polarización de la luz hacia la izquierda (levógiro) y se identifica con la letra S .Este tipo de nomenclatura recibe el nombre de NOMENCLATURA R, S
Sinopsis Isomería
Isomería Misma fórmula molecular y distintas propiedades |
Isómeros constitucionales Mismos átomos con distinta conectividad. (Diferente fórmula estructural) |
||
Estereoisómeros Mismos átomos con diferente disposición espacia |
Isomería conformacional Diferentes conformaciones |
||
Isomería configuracional Diferentes configuraciones |
Enantiómeros Estereoisómeros que son imágenes especulares |
||
Diastereoisómeros Estereoisómeros que no son imágenes especulares |
|||
| Arriba | Indice Qca. Orgánica | Siguiente |
