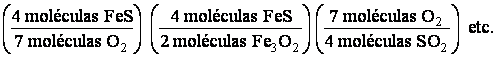

| Menú Química | Anterior: Reacciones Químicas |
La estequiometría se refiere a las cantidades de reaccionantes y productos comprendidos en las reacciones químicas. Para una reacción hipotética;
| A |
+ |
B |
→ |
C |
+ |
D |
Surgen preguntas como estas ¿ Cuanto se necesita de A para que reaccione con x gramos de B? ¿ Cuanto se producirá de C en la reacción de A con x gramos de B? ¿ Cuanto se producirá de B junto con Y gramos de C?. Las cantidades químicas es decir, el "cuanto" de las preguntas anteriores se pueden medir de diferentes maneras. Los sólidos generalmente se miden en gramos, los líquidos en mililitros y los gases en litros. Todas estas unidades de cantidad se pueden expresar también en otra unidad, el "mol".
La razón de dos cantidades cualesquiera en la ecuación balanceada nos da el " factor químico" de conversión, que permite pasar de las moléculas de una sustancia al numero equivalente de moléculas de otras sustancia implicada en la reacción, a apartir de la ecuación balanceada;
| 4FeS |
+ |
7O2 |
→ |
2Fe2O3 |
+ |
4SO2 |
Se puede escribir los siguientes factores químicos de conversión
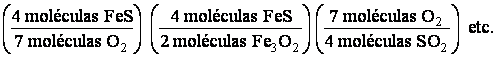
De la misma manera como las fórmulas pueden interpretarse directamente en términos de moles o de moléculas. Para demostrar esto, multipliquese cada término en ambos miembros de la ecuación anterior por el numero de Avogadro,6.02 x 10 23. Esto no altera la igualdad. la ecuación resultante es:
| 4( 6.02 x 1023 ) FeS |
+ |
7( 6.02 x 1023 ) O2 |
→ |
2( 6.02 x 1023 ) Fe2O3 |
+ |
4( 6.02 x 1023 ) SO2 |
Observe que 6.02 x 1023 moléculas de una sustancia son exactamente 1 mol de esa sustancia. Así se puede sustituir este numero por su equivalente en moles y la ecuación se convierte en :
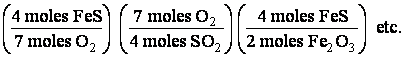
Siguiendo un razonamiento similar al usado con las moléculas, podemos obtener factores químicos en términos de moles. Así, tenemos los siguientes factores de conversión.
Existe una ley llamada ley de la composición definida que establece que cuando las sustancias reaccionara para formar compuestos lo hacen en relaciones definidas de masas. por ejemplo:
| 4FeS |
+ |
7O2 |
→ |
2Fe2O3 |
+ |
4SO2 |
| 4 moles | 7 moles | 2 moles | 4 moles | |||
| 4 x 87.91 g | 7 x 32 g | 2 x 159.69 g | 4 x 64.06 g |
muestra que 4 moles de FeS ( 4 x 87.091 g de FeS) reaccionan con 7 moles de O2(7 x 32 g de O2) para formar 2 moles de Fe2O3 y 4 moles de SO2 ( 4 x 64.06 g ) de los productos ( 319.38 + 256.24) ( ley de la conservación de la masa)
1. Cálculos masa a masa
La relación entre la masa de un reactante y la masa correspondiente de un producto es uno de los problemas de mayor frecuencia en química. Hay varios métodos para resolver este tipo de problemas.
EJEMPLO:
En la obtención de oxígeno, se descompone clorato de potasio por calentamiento. En una experiencia a partir de 30 g. de clorato, cuántos gramos de oxígeno se obtienen ?
(a) Método de las proporciones :
Se procede a escribir la ecuación química equilibrada :
| 2KClO3 | → |
2KCl |
+ |
3O2 |
Se hallan los pesos mol de las sustancias problema :
Peso de 1 mol de KCl3 = 122,55 g
Peso de 1 mol de O2 = 32 g
De acuerdo con la ecuación :
245,10 g de KClO3 producen 96 g de O2
30 g de KClO3 X
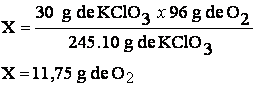
(b) Método del factor de la conversión :
Resumiendo la información cuantitativa que da la ecuación :
| 2KClO3 | → |
2KCl |
+ |
3O2 |
| 245,10 g | 96 g |
Se puede obtener un factor de conversión para pasar gramos de KClO3 ( sustancia conocida ) a gramos de oxígeno ( sustancia problema ).
El factor es :
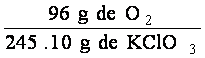
Se multiplica la cantidad de sustancia dada, KClO3, por el factor de conversión para hallar la cantidad buscada :
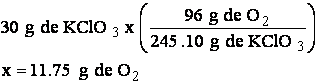
2. Cálculos mol-mol
Los problemas estequiometrícos más simples son aquellos en los cuales se calcula el número de moles de una sustancia, que han reaccionado con, o se producen a partir de un cierto número de moles de otra sustancia.
EJEMPLO:
Cuantas moles de nitrógeno reaccionan con 0.75 moles de hidrógeno en la producción del amoníaco ?.
La ecuación equilibrada para esta reacción es :
| N2 | + | 3H2 |
→ |
2NH3 |
La ecuación equilibrada nos indica :
1 mol N2 reacciona con 3 moles H2
X moles N2 reaccionan con 0.75 moles H2
X = 0.25 moles de N2
3. Cálculos con reactivo límite
Generalmente en el laboratorio es difícil tomar las cantidades precisas de cada uno de los reactivos para las diferentes experiencias, ocasionando el exceso de uno de los reactivos . Los cálculos para determinar la cantidad de producto esperado se realizan teniendo en cuenta la sustancia que se consume en forma total o reactivo límite.
EJEMPLO:
Se hacen reaccionar 15 g de NaOH con 15 g de HCl para producir agua y cloruro de sodio. Cuántos gramos de NaCl se obtienen?
La ecuación equilibrada es :
| NaOH |
+ |
HCl |
→ |
NaCl |
+ |
H2O |
Lo primero que se debe hacer es determinar cuál es el reactivo límite. De acuerdo con la ecuación tenemos que :
39,98 g de NaOH se combinan con 36,45 g de HCl
15 g de NaOH se combinarán con X
X = 13,67 g de HCl
Significa que en la reacción únicamente 15 g de NaOH requieren combinarse con 13,67 g de HCL, quedando en exceso 1,33 g de HCl. Por tanto, el reactivo límite es el NaOH y con esa cantidad problema debemos determinar la cantidad de producto obtenido :
39,98 g de NaOH producen 58,43 g de NaCl
15 g de NaOH producirían X g de NaCl