
| Menú Química | Anterior: Periodicidad Química | Siguiente: Nomenclatura Química |
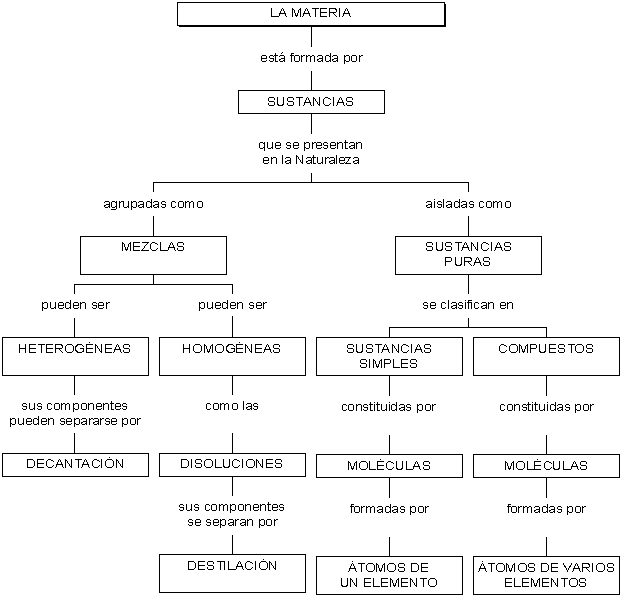
La materia es todo aquello que nos rodea, ocupa un lugar en el espacio y tiene masa,

Todo lo que nos rodea y que sabemos como es se le llama materia. Aquello que existe pero no sabemos como es se le llama no-materia o antimateria.
Al observar la materia nos damos cuenta que existen muchas clases de ella porque la materia tiene propiedades generales y propiedades particulares.
Las propiedades generales son aquellas que presentan características iguales para todo tipo de materia. Dentro de las propiedades generales tenemos:
|
Masa = |
Es la cantidad de materia que posee un cuerpo. |
|
Peso = |
Es la fuerza de atracción llamada gravedad que ejerce la tierra sobre la materia para llevarla hacia su centro. |
|
Extensión = |
Es la propiedad que tienen los cuerpos de ocupar un lugar determinado en el espacio. |
|
Impenetrabilidad = |
Es la propiedad que dice que dos cuerpos no ocupan el mismo tiempo o el mismo espacio. |
|
|
Es la propiedad que indica que todo cuerpo va a permanecer en estado de reposo o movimiento mientras no exista una fuerza externa que cambie dicho estado de reposo o movimiento. |
|
Porosidad = |
Es la propiedad que dice que como la materia esta constituida por moléculas entre ellas hay un espacio que se llama poro. |
|
Elasticidad = |
Es la propiedad que indica que cuando a un cuerpo se le aplica una fuerza esta se deforma y que al dejar de aplicar dicha fuerza el cuerpo recupera su forma original; lógicamente sin pasar él limite de elasticidad. "limite de influenza " |
|
Divisibilidad = |
Esta propiedad demuestra que toda la materia se puede dividir. |
Todas las sustancias al formarse como materia presentan unas propiedades que las distinguen de otras y esas propiedades reciben el nombre de especificas y dichas propiedades reciben el nombre de color, olor, sabor, estado de agregación, densidad, punto de ebullición, solubilidad, etc.
El color, olor y sabor demuestra que toda la materia tiene diferentes colores, sabores u olores.
El estado de de agregación indica que la materia se puede presentar en estado sólido, liquido o gaseoso.
La densidad es la que indica que las sustancias tienen diferentes pesos y que por eso no se pueden unir fácilmente .
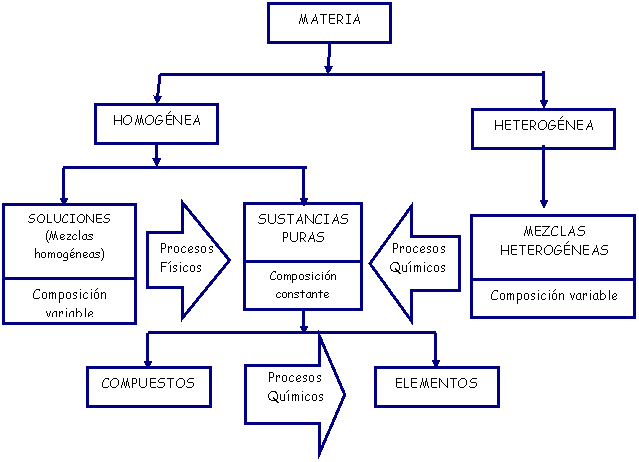
| Materia heterogéneo |
Es una mezcla de sustancias en más de una fase o que son físicamente distinguibles. |
EJEMPLO: mezcla de agua y aceite. |
| Material homogéneo: |
Constituido por una sola sustancia o por varias que se encuentran en una sola fase |
EJEMPLO: mezcla de sal y agua. |
| Solución: |
Es un material homogéneo constituido por más de una sustancia. Son transparentes, estables y no producen precipitaciones. Una característica muy importante es la composición, la cual es igual en todas sus partes. Sin embargo, con los mismos componentes es posible preparar muchas otras soluciones con solo variar la proporción de aquellos |
EJEMPLO: las gaseosas. |
| Sustancia pura: |
Es un material homogéneo cuya composición química es invariable. |
EJEMPLO: alcohol (etanol) |
| Elemento: |
Sustancia conformada por una sola clase de átomos |
EJEMPLO: nitrógeno gaseoso (N2), la plata (Ag) |
| Compuesto: |
Sustancia conformada por varias clases de átomos |
EJEMPLO: dióxido de carbono (CO2) |
| Cambio físico: | Cambio que sufre la materia en su estado, volumen o forma sin alterar su composición. |
EJEMPLO: en la fusión del hielo, el agua pasa de estado sólido a líquido, pero su composición permanece inalterada. |
| Cambio químico: | Cambio en la naturaleza de la materia, variación en su composición |
EJEMPLO: en la combustión de una hoja de papel, se genera CO, CO2 y H2O a partir de celulosa, cambiando la composición de la sustancia inicial. |
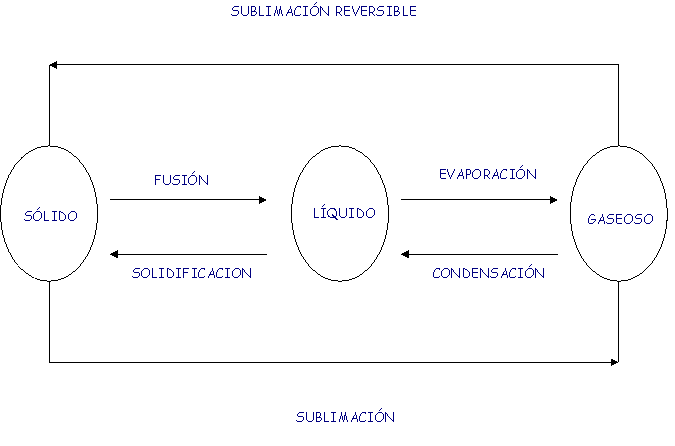
| Cambios de estado: | El estado en que se encuentre un material depende de las condiciones de presión y temperatura, modificando una de éstas variables o ambas, se puede pasar la materia de un estado a otro. |
Sólido, liquido, gaseoso o plasma |
|
SÓLIDOS |
LÍQUIDOS |
GASES |
|
|
COMPRESIBILIDAD |
No se pueden comprimir |
No se pueden comprimir |
Sí pueden comprimirse |
|
VOLUMEN |
No se adaptan al volumen del recipiente |
Se adaptan al volumen del recipiente |
Se adaptan al volumen del recipiente |
|
GRADOS DE LIBERTAD |
Vibración |
Vibración, rotación |
Vibración, rotación, traslación |
|
EXPANSIBILIDAD |
No se expanden |
No se expanden |
Sí se expanden |
Molécula : se forman por enlaces químicos de dos o más átomos y siempre en proporciones definidas y constantes. Son la estructura fundamental de un compuesto.
Fórmula:
|
Fórmula química |
Fórmula empírica o mínima |
Fórmula molecular |
Fórmula estructural : |
Fórmula de Lewis o electrónica: |
| Es la representación de un compuesto e indica la clase y la cantidad de átomos que forman una molécula.
Está constituido por el símbolo de cada elemento presente en la sustancia, seguido por un subíndice que índica el número relativo de átomos. |
Informa sobre el tipo de átomos que forman la molécula y la relación mínima en la cual estos se combinan. | Expresa la composición real de un compuesto, indicando el número de átomos de cada especie que forma la molécula. La fórmula molecular es un múltiplo de la empírica. | Muestra el ordenamiento geométrico o posición que ocupa cada átomo dentro de la molécula. |
Representa la molécula incluyendo todos los electrones de valencia de los átomos constituyentes, estén o no comprometidos en enlaces. |
EJEMPLO: Fe2O3 |
EJEMPLO: La fórmula mínima del etano (C2H6) es CH3 |
EJEMPLO: |
EJEMPLO: |
EJEMPLO:
|
| Mol: | Es el número de partículas igual al número de Avogadro |
| Nùmero de Avogadro | 6.023 x 1023 partículas |
| Peso Atómico: | Es el peso de una mol de átomos de un elemento.
EJEMPLO: En un mol de Fe (hierro) hay 6.023 x 1023 átomos de hierro y estos pesan en total 55.8 g
Unidades de Masa Atómica u.m.a La unidad de masa atómica uma es en realidad una unidad de peso y se define exactamente como 1/2 de la masa del átomo de 12C. Su tamaño extremadamente pequeño es cómodo para la descripción del peso de los átomos. Por ejemplo, el peso real de un átomo de hidrogeno es 1.67 x 10-24 g 0 1.008 uma. Como todos los pesos atómicos se basan en el mismo patrón, todos ellos pueden utilizarse para comparar los pesos de dos átomos cualesquiera. Así , el peso atómico del azufre, 32.06 uma, indica que: El cobre tiene un peso atómico de 63.54 uma. Por consiguiente, en consecuencia: |
| Peso Molecular: | Es el peso de una mol de moléculas de un compuesto. Se obtiene sumando el peso atómico de todos los átomos que forman la molécula.
1 MOL = 6.023 x 1023 moléculas = peso molecular (peso fórmula)
hidrógeno 2 x 1 = 2 |
| Relación entre mol, peso molecular y número de partículas: |
|
EJEMPLO: Determine la Fórmula Empírica y la Fórmula Molecular de un compuesto que contiene 40.0 % de C, 6.67 % de H y 53.3 % de O y tiene un peso molecular de 180.2 g/mol .
PARA DETERMINAR LA FORMULA EMPÍRICA:
Cuando los datos se expresan como porcentaje, se pueden considerar 100 gramos del compuesto para realizar los cálculos. Los pesos atómicos son:
C = 12.0, O = 16.0 y H = 1.0
El primer paso para el cálculo es determinar el número de moles de cada elemento.
# moles de C = 40/12.0 = 3.33
# moles de O = 53.3/16.0 = 3.33
# moles de H = 6.67/1.0 = 6.67
El siguiente paso consiste en dividir cada valor entre el valor más pequeño.
C = 3.33/3.33 = 1
O = 3.33/3.33 = 1
H = 6.67/3.33 = 2
Puede apreciarse que los valores obtenidos son los números enteros más pequeños y la fórmula empírica será: C1H2O1 o bien, CH2O.
PARA DETERMINAR LA FORMULA MOLECULAR:
Para obtener la Fórmula Molecular, calculemos el peso de la Fórmula empírica:
C = (12.0)x(1) = 12.0
H = (1.0)x(2) = 2.0
O = (16.0)x(1) = 16.0
Suma = 30.0
Ahora se divide el Peso Molecular entre el Peso de la Fórmula Empírica
180/30 = 6
La Fórmula Molecular será igual a 6 veces la Fórmula empírica:
C6H12O6
En los casos en que una fórmula empírica dé una fracción, como por ejemplo: PO2.5
habrá que multiplicar por un número entero que nos proporcione la relación buscada, por ejemplo 2 : P2O5
EJEMPLO:
Primero deben consultarse los Pesos Atómicos del Bario y del Cloro. Estos son:
| Peso Atómico (P. A.) del Bario | = | 137.3 g/mol |
| Peso Atómico (P. A.) del Cloro | = | 35.5 g/mol |
| Peso Fórmula del BaCl2 | = | (1) x (P. A. del Bario) + (2) x (P. A. del Cloro) |
| Peso Fórmula del BaCl2 | = | (1) x (137.3) + (2) x (35.5) = 137.3 + 71 = 208.3 |
EJEMPLO:
Primero se consulta el Peso Atómico del Aluminio, el cual es 27 g/mol. En seguida hacemos el planteamiento:
27 gramos de Al ------ 1 Mol de Aluminio
125 gramos de Al ----- ?
Moles de Aluminio = 49.25 Moles de Aluminio
También es posible determinar al composición porcentual utilizando factores de conversión;
EJEMPLO:
La solución del problema cuando se aplica a 100 g del compuesto es como sigue :
Peso del C= 85.63 g peso del H = 14.37 g
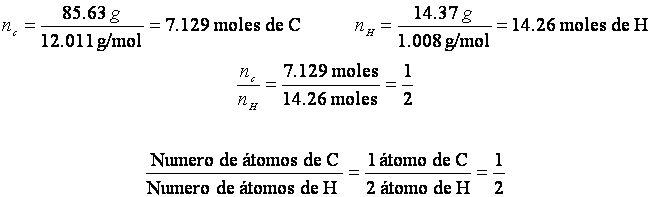
La formula empírica es CH2. La formula molecular puede ser CH2, C2H4, C3H6, etc, puesto que cualquiera de estas formulas tienen una composición porcentual igual a la de CH2.
EJEMPLO:
La fórmula empírica expresa solamente el número relativo de los átomos de cada elemento y todo lo que se dice acerca de los números relativos de los átomos de cada elemento se pude aplicar a los numero relativos de moles de átomos. Por tanto el calculo del numero relativo de moles de hierro y de azufre conducirá a la formula empírica. La solución, cuando se aplica a 100 g del compuesto, es como sigue:
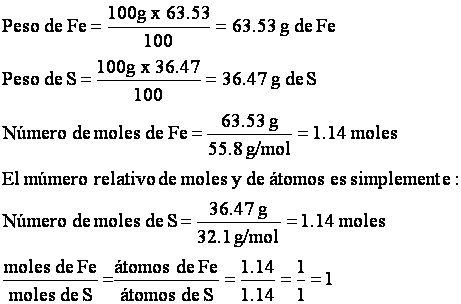
La formula empírica del sulfuro es FeS
EJEMPLO:
La manera más conveniente de resolver el problema es conocer el número relativo de átomos ; para lograrlo, dividimos por el número menor, es decir, 4.816 x 1023
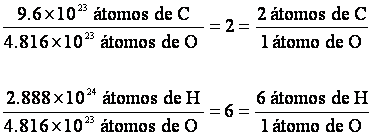
Por cada átomo de O, tenemos de 2 de C y 6 de H. Así, fórmula empírica es C2H6O
ESTRUCTURAS DE LEWIS Y FÓRMULA ESTRUCTURAL
EJEMPLO:
Escribir la fórmula de lewis para a) Be, b) O, c) F, d) Li
Si representamos con puntos los electrones de valencia ( los que participan en el enlace químico) tenemos:
| a) | |
Dos electrones s, puesto que su configuración electrónica 1s2 2s2 indica que haya dos electrones en el nivel de valencia. |
|
b) |
|
Dos electrones s y cuatro electrones p, de acuerdo con su configuración electrónica 1s2 2s2 2p4; en total, 6 electrones de valencia. |
|
c) |
|
Dos electrones s y cinco electrones p ( configuración electrónica 1s2 2s2 2p4) |
| d) | |
Un electrón s ( configuración electrónica 1s2 2s1). |
EJEMPLO:
De acuerdo con la regla del octeto , escribir las formulas electrónicas y estructurales de a) HF, b) CH4 , c) H2S.
Se acostumbra usar una línea para representar un par compartido de electrones entre dos átomos.
|
( fórmula electrónica o de Lewis) |
( fórmula estructural) |
|
| a) |
|
|
| b) | ||
| c) |
ENERGÍA
La Energía es la capacidad para realizar un trabajo. Se presenta en diferentes formas: potencial, cinética, eléctrica, calórica, lumínica, nuclear y química.
| 1 caloría |
= |
4.184 joules | = | 4.184 J | |||
| 1 kilocaloría | = | 1000 calorías | = | 1kcal | |||
| 1 joule | = |
1 newton |
x |
1 metro |
|||
| (unidad de fuerza) | (unidad de longitud) | ||||||
| 1 newton | = | 1 kilogramo | x | 1 metro | x | ( 1 segundo) -2 | |
| 1 joule | = | 1 kilogramo |
x |
1 metro 2 | x | ( 1 segundo) -2 | |
|
1 J = 1 kg m2 s-2 |
|||||||
| Caloría = | Es la cantidad de calor necesaria para elevar en 1º C un gramo de agua. |
|
Calor = |
Es una forma de energía que fluye entre cuerpos debido a una diferencia de temperatura. El calor fluye de un cuerpo caliente a uno frío, hasta que los dos alcanzan igual temperatura. |
| Calor específico = | Es la cantidad de calor que se requiere para elevar la temperatura de un gramo de una sustancia en un grado centígrado. Ejemplo: Cp del oro: 0.129 J/ g ºC, lo cual indica que son necesarios 0.129 J para elevar en 1°C la temperatura de 1 g de oro. |
| Temperatura = | Es la medida de la cantidad de calor que tiene un cuerpo. La escala Celsius al igual que las escalas Fahrenheit y la escala Kelvin o absoluta sirven para determinar la temperatura de un cuerpo. Guardan la siguiente relación |
|
°C = 5/9 (°F – 32 ) |
|
|
°K = °C + 273 |
|
|
°F = 9/5 °C + 32 |
|
comparación de los termómetros en las escalas Kelvin, Celsius y Fahrenheit |
|||||||
|
Punto de ebullición del agua Punto de congelación del agua Cero absoluto de Temperatura |
|
373 K
273 K 0 K |
|
100°C 0°C -273°C |
100° = 180°F |
212°F 32°F -460°F |
|
|
Kelvin (escala absoluta) |
Celsius (centígrado) |
Fahrenheit |
|||||
| PRIMERA: | (Ley de Lavoisier) | En una reacción química ordinaria la masa de todos los productos es igual a la masa de las sustancias reaccionantes |
| SEGUNDA : | (ley de la Termodinámica ) | La energía no se crea ni se destruye , solo se transforma. |
| TERCERA : | ( Ley de Einstein ) | La materia y al energía pueden transformarse mutuamente , pero la suma total de la materia y la energía del universo es constante. |