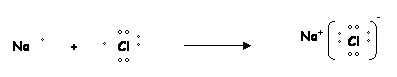INTRODUCCIÓN
Cuando se acercan dos átomos mutuamente, se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tratan de mantener los átomos unidos, otras tienden a separarlos. en la mayoría de los átomos, con excepción de los gases nobles , las fuerzas atractivas son superiores a las repulsivas y los átomos se acercan formando un enlace. Así, se considera al enlace químico como la fuerza que mantiene unidos a dos o más átomos dentro de una molécula.
Los átomos tienden a perder, ganar o compartir electrones en forma tal que queden con un total de 8 electrones en su nivel energético más exterior, esta configuración les proporciona gran estabilidad.
IONES: átomos o conjunto de átomos que poseen carga eléctrica.
Catión: ion con carga positiva. Ejemplo: Ca+2 ion calcio, NH4+ ion amonio
Anión: ion con carga negativa. Ejemplo: Br- ion bromuro, ClO2- ion clorito
EJEMPLOS:
El sodio tiene un potencial de ionización bajo y puede perder fácilmente su electrón 3s
| Na0 |
→ |
Na+ |
+ |
1e- |
| 1s2 2s2 2p6 3s1 |
→ |
1s2 2s2 2p6 |
+ |
1e- |
| átomo de sodio |
|
ion de sodio |
|
|
La estructura electrónica del ion sodio resultante es exactamente igual a la del gas noble neón. este ion es una especie muy estable.
Otros elementos ganan electrones para llenar la capa de valencia y alcanzar la configuración estable de 8 electrones. El cloro es un ejemplo:
| Cl0 |
→ |
1e- |
+ |
Cl- |
| 1s2 2s2 2p6 3s2 3p5 |
→ |
|
+ |
1s2 2s2 2p6 3s2 3p6 |
| átomo de cloro |
|
|
|
ion cloruro |
| ENLACE IÓNICO: |
Este enlace se origina cuando se transfiere uno o varios electrones de un átomo a otro. Debido al intercambio electrónico, los átomos se cargan positiva y negativamente, estableciéndose así una fuerza de atracción electrostática que los enlaza. Se forma entre dos átomos con una apreciable diferencia de electronegatividades, los elementos de los grupos I y II A forman enlaces iónicos con los elementos de los grupos VI y VII A. |
EJEMPLO:
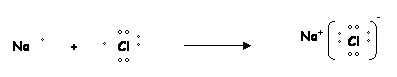 |
| ENLACE COVALENTE |
Se presenta cuando se comparten uno o más pares de electrones entre dos átomos cuya diferencia de electronegatividad es pequeña. |
EJEMPLO:
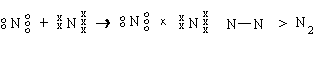 |
| Enlace covalente apolar: |
Se establece entre átomos con igual electronegatividad. Átomos del mismo elemento presentan este tipo de enlace. |
EJEMPLO:
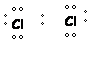 |
| Enlace covalente polar: |
Se establece entre átomos con electronegatividades próximas pero no iguales |
EJEMPLO:
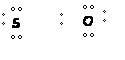 |
| Enlace covalente coordinado: |
Se establece por compartición de electrones entre dos átomos pero un átomo aporta el par de electrones compartidos.
|
EJEMPLO:
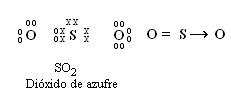 |
| ENLACE METÁLICO |
Los electrones que participan en él se mueven libremente, a causa de la poca fuerza de atracción del núcleo sobre los electrones de su periferia.
|
Basado en la diferencia de electronegatividad entre los átomos que forman el enlace puede predecirse el tipo de enlace que se formará:
| Si la diferencia de electronegatividades es mayor que 2. |
= |
se formará un enlace iónico |
| Si la diferencia de electronegatividades es mayor que 0.5 y menor a 2.0. |
= |
el enlace formado será covalente polar |
| Si la diferencia de electronegatividades es menor a 0.5 |
= |
el enlace será covalente puro (o no polar). |
EJEMPLOS:
- Qué tipo de enlace se formará entre H y O?
Según la Tabla de Electronegatividades de Pauli, el Hidrógeno tiene una Electronegatividad de 2.2 y el Oxígeno 3.44, por lo tanto la diferencia de electronegatividades será:
3.44 - 2.2 = 1.24
1.24 es menor que 2.0 y mayor que 0.5.
Por lo tanto, el enlace será Covalente Polar.
- Decidir si se puede aplicar o no la regla del octeto a las moléculas de: (a) BeCl2, (b) BCl3.
Como la regla del octeto se basa en el hecho de que todos los gases raros tienen una estructura de ocho electrones, basta con ver si el átomo central completa ocho electrones en la capa de valencia.
| (a) Los electrones de valencia asociados con Be (2s2) son: |
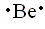 |
y con Cl (3s2 3p5) son: |
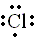 |
la estructura de lewis será: |
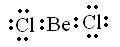
El berilio está rodeado únicamente de cuatro electrones, luego es una excepción a la regla del octeto.
| (b) Los electrones de valencia asociados con B (2s2 2p1) son: |
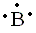 |
y con Cl (3s2 3p5) son: |
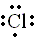 |
la estructura electrónica o de Lewis será |
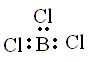
El boro esta rodeado únicamente de seis electrones, luego no cumple la regla del octeto
- Explicar la formación del enlace covalente en la molécula de cloruro de hidrogeno gaseoso, HCl.
Usamos los diagramas de Lewis para representar los electrones de valencia:
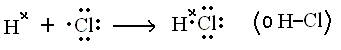
El átomo de cloro completa el octeto compartiendo el electrón del átomo de H; así, el cloro alcanza la configuración del gas noble y el hidrogeno alcanza la configuración del gas noble